
Vad kan ett läkemedel
Mysimba® (naltrexon/ bupropion) är en tablettbehandling mot obesitas som genom sina två komponenter, påverkar hungercentrum och belöningssystemet i hjärnan.* (1-3)
Mysimba minskar hungerkänslor och ökar patientens kontroll över sitt matintag, något som, i tillägg till kalorireducerad kost och ökad fysisk aktivitet, kan leda till en signifikant och bestående viktminskning. (3, 4)
Mysimba är ett varumärke registrerat av Nalpropion Pharmaceuticals LCC. © 2020 Nalpropion Pharmaceuticals LCC. EU/1/14/988 MYS-0179-002, 06/21 För mer information, kontakta Navamedic AB, Göteborgsvägen 74, Sävedalen, +46 31 335 1190, www.navamedic.com

En kombination av två välkända aktiva substanser
Naltrexon är en μ-opioidreceptorantagonist. Bupropion är en selektiv neuronal återupptagshämmare av noradrenalin och dopamin. Båda substanserna har väldokumenterade säkerhetsprofiler och har använts för behandling av alkoholberoende, depression och rökavvänjning med upp till 30 års erfarenhet. (1)
▼ Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning.
Verkningsmekanism
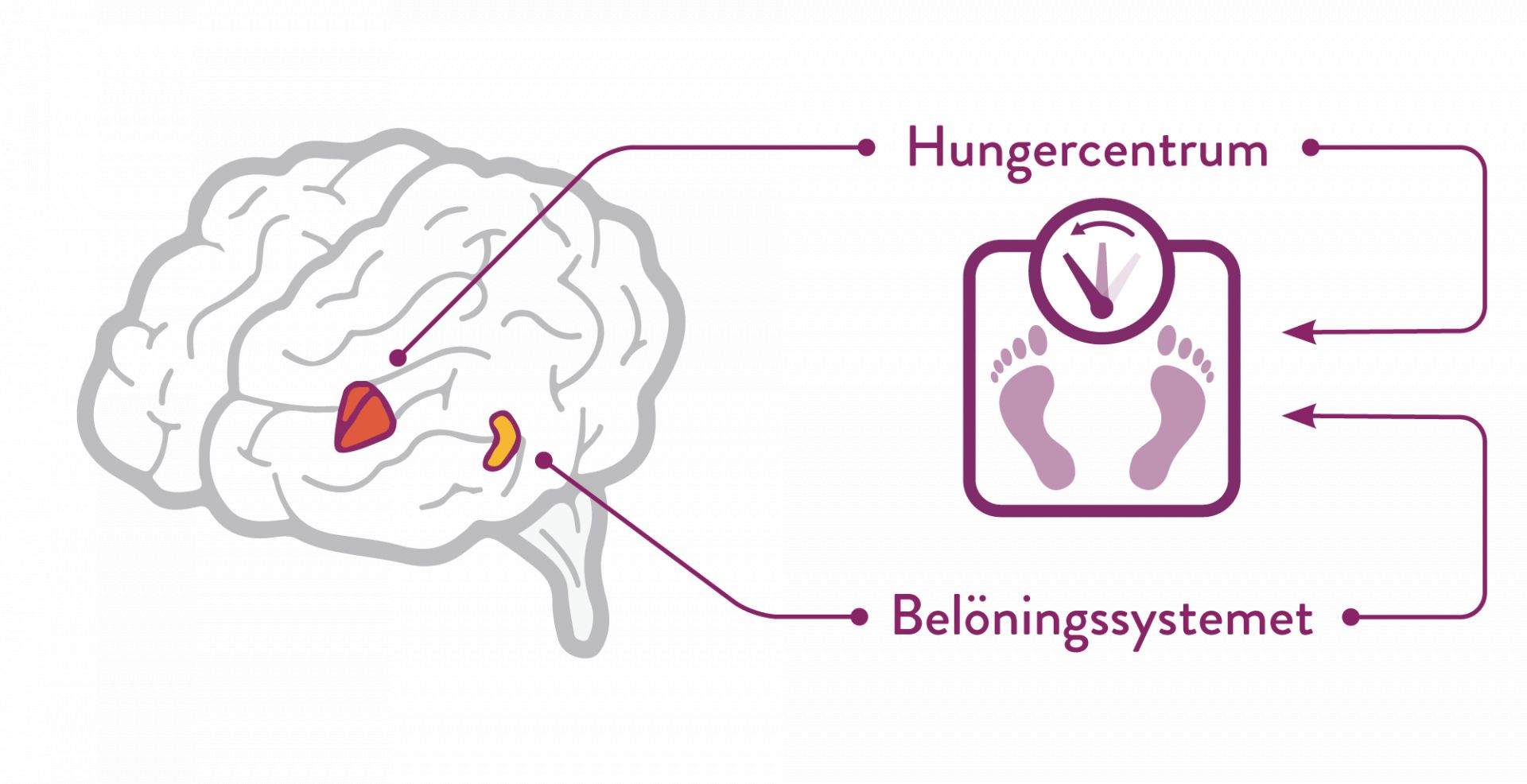
Mysimba påverkar huvudsakligen två områden i hjärnan; arkuatuskärnan i hypotalamus (hungercentrum) och det mesolimbiska dopaminerga belöningssystemet (ventrala tegmentområdet, accumbenskärnan och prefrontala cortex). (1)*
Bupropion stimulerar POMC†- neuron i hypotalamus som anses ha betydelse för aptitreglering och energibalans. Vid stimulering av POMC-neuron frisätts ett melanocytstimulerande hormon (α-MSH), som i sin tur binder till och stimulerar melakortinreceptorer (MC4-R). Stimuleringen leder till minskad aptit, vilket leder till en viktminskning. (1)
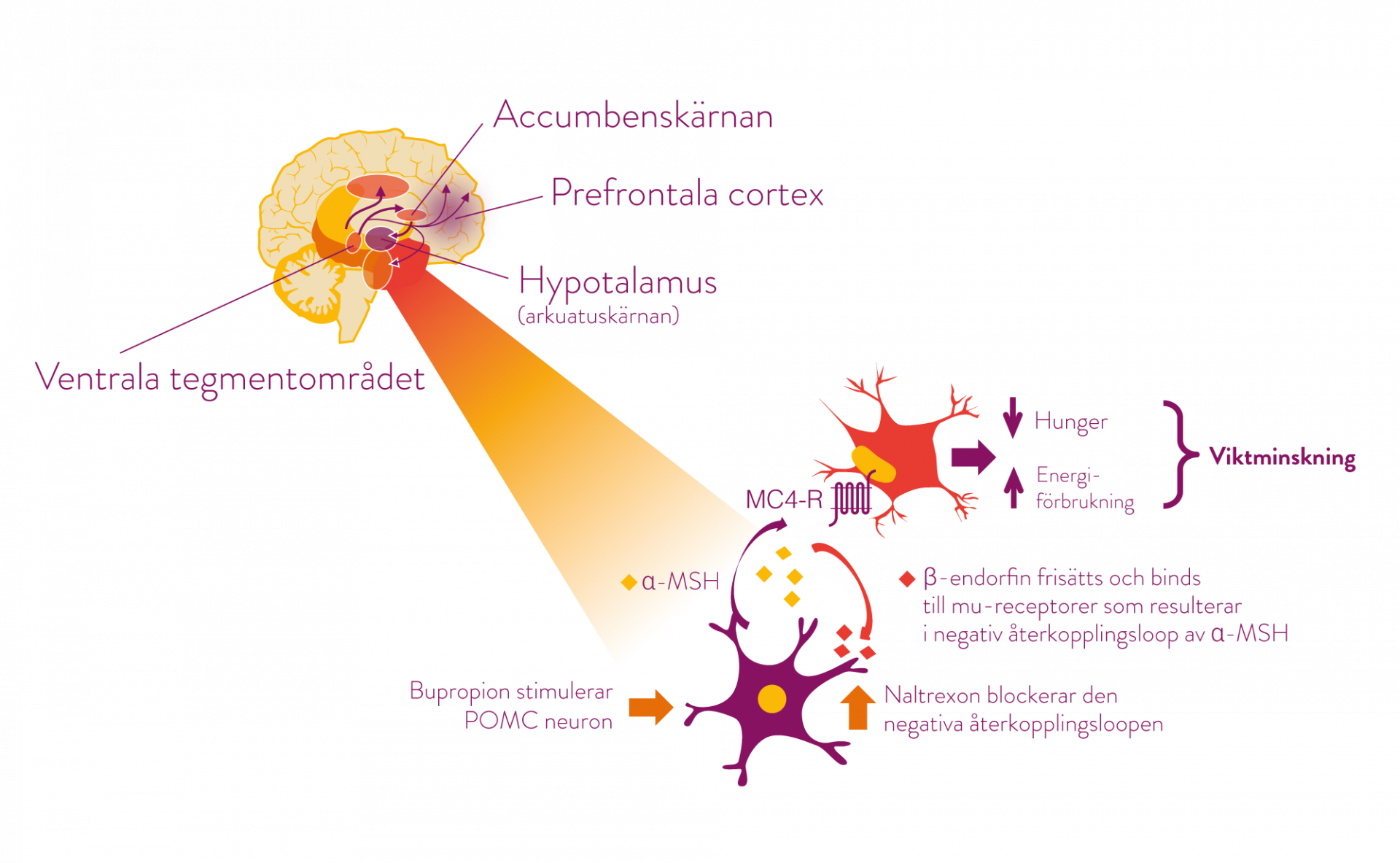
När α-MSH frisätts sker en samtidig frisättning av β-endorfin från POMC-neuronen som binds till μ-opioida receptorer på samma neuron. Bindningen åstadkommer en negativ återkopplingsloop vilket leder till minskad frisättning av α-MSH. Naltrexon blockerar denna negativa återkopplingsloop och därigenom förstärks och förlängs bupropions effekter i hungercentrum. (1)
*Den exakta neurokemiska aptitdämpande effekten av naltrexon/bupropion är ännu inte fullt klarlagd.
† Proopiomelanokortin

Vilka patienter är aktuella för behandling med Mysimba?
Mysimba är avsett som tillägg till en kalorireducerad kost och ökad fysisk aktivitet för vikthantering hos vuxna patienter (≥ 18 år) med ett initialt kroppsmasseindex (BMI) på:
- ≥ 30 kg/m2 (fetma) eller
- ≥ 27 kg/m2 till < 30 kg/m2 (övervikt) tillsammans med en eller flera viktrelaterade komorbiditeter (t.ex. typ 2-diabetes, dyslipidemi eller kontrollerad hypertoni). (1)
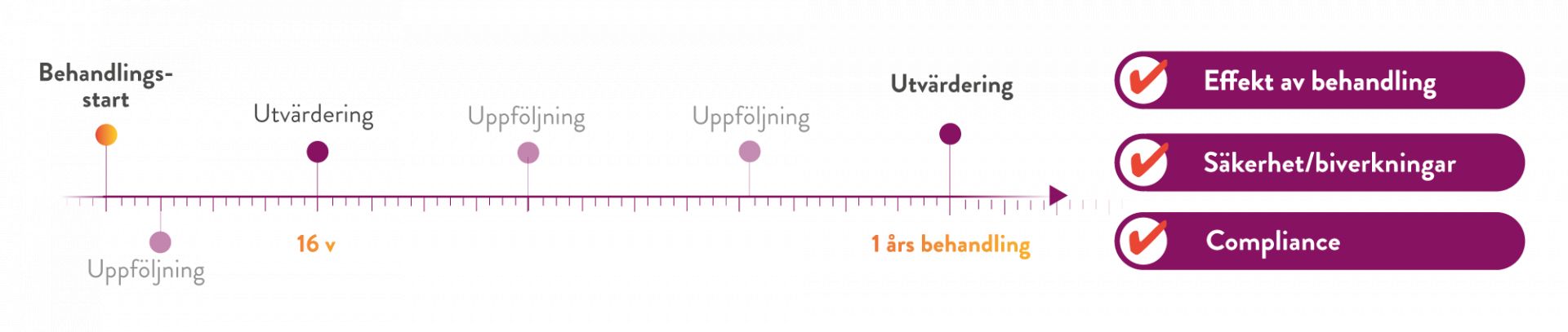
Behandling med Mysimba ska avbrytas efter 16 veckor om patienten inte har tappat minst 5 % av sin initiala kroppsvikt. (1, 5)
Mysimba-responders och non-responders (5)
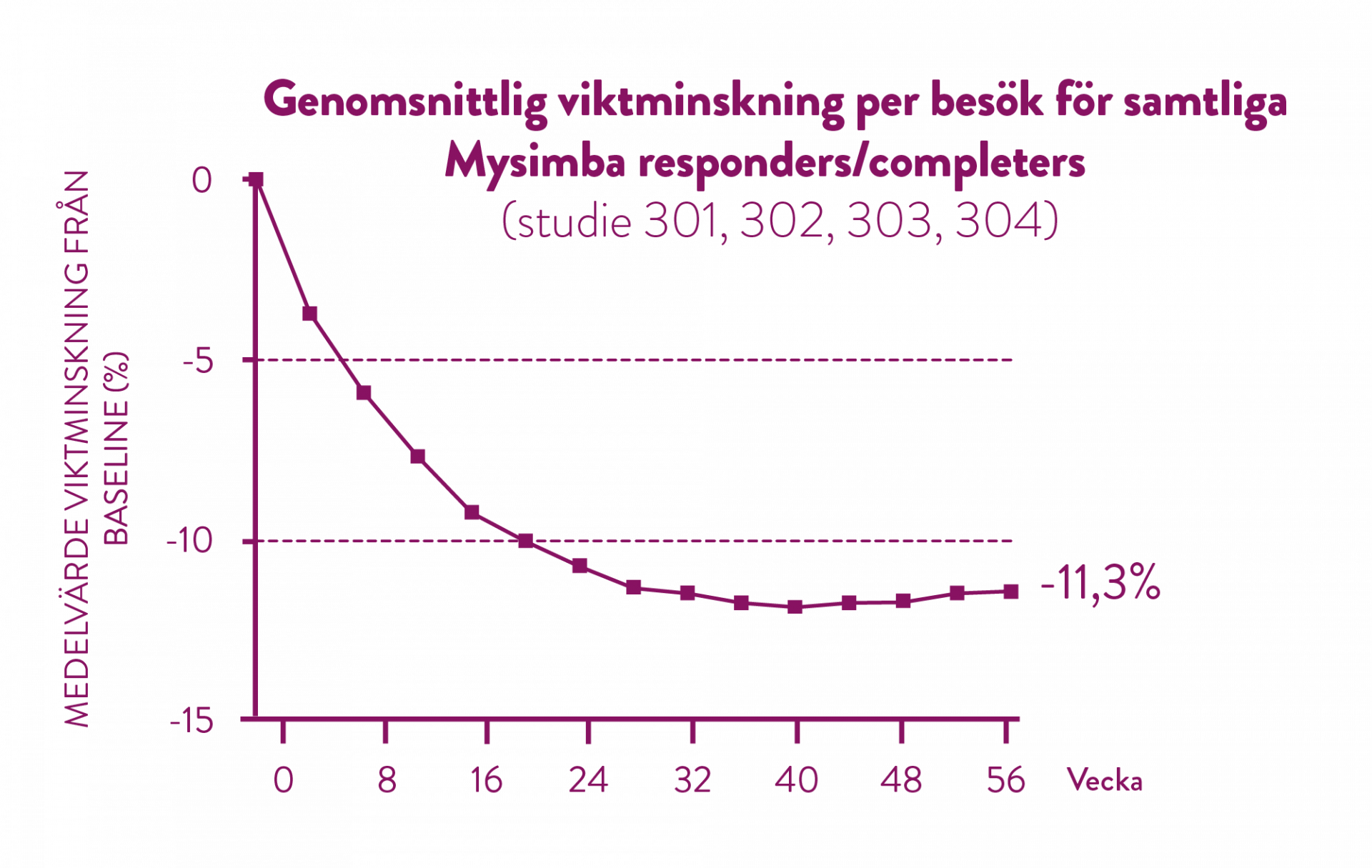
Det kliniska prövningsprogrammet visade att 51 % av patienterna kan förväntas få en viktminskning på minst 5 % efter 16 veckors behandling. Dessa patienter kategoriseras som Mysimba-responders. Viktminskningströskeln på ≥ 5 % vecka 16 hade 86,4 % positivt prediktivt värde och 84,8 % negativt prediktivt värde för bestämning av om en försöksperson behandlad med Mysimba skulle uppnå minst 5 % viktminskning vecka 56. Som non-responders för Mysimba räknades de patienter som inte uppfyllde det tidiga svarskriteriet vecka 16. (5)

Checklista för behandling
För att säkerställa rätt urval av patienter för behandling av Mysimba ska även följande checklista fyllas i.
Tydliga resultat, bestående viktminskning (1, 6-9)
Mysimba är undersökt i fyra randomiserade, dubbelblinda, placebokontrollerade 56-veckors studier med totalt 4 536 patienter. (1, 6-9)

Signifikant viktminskning mot placebo (5)
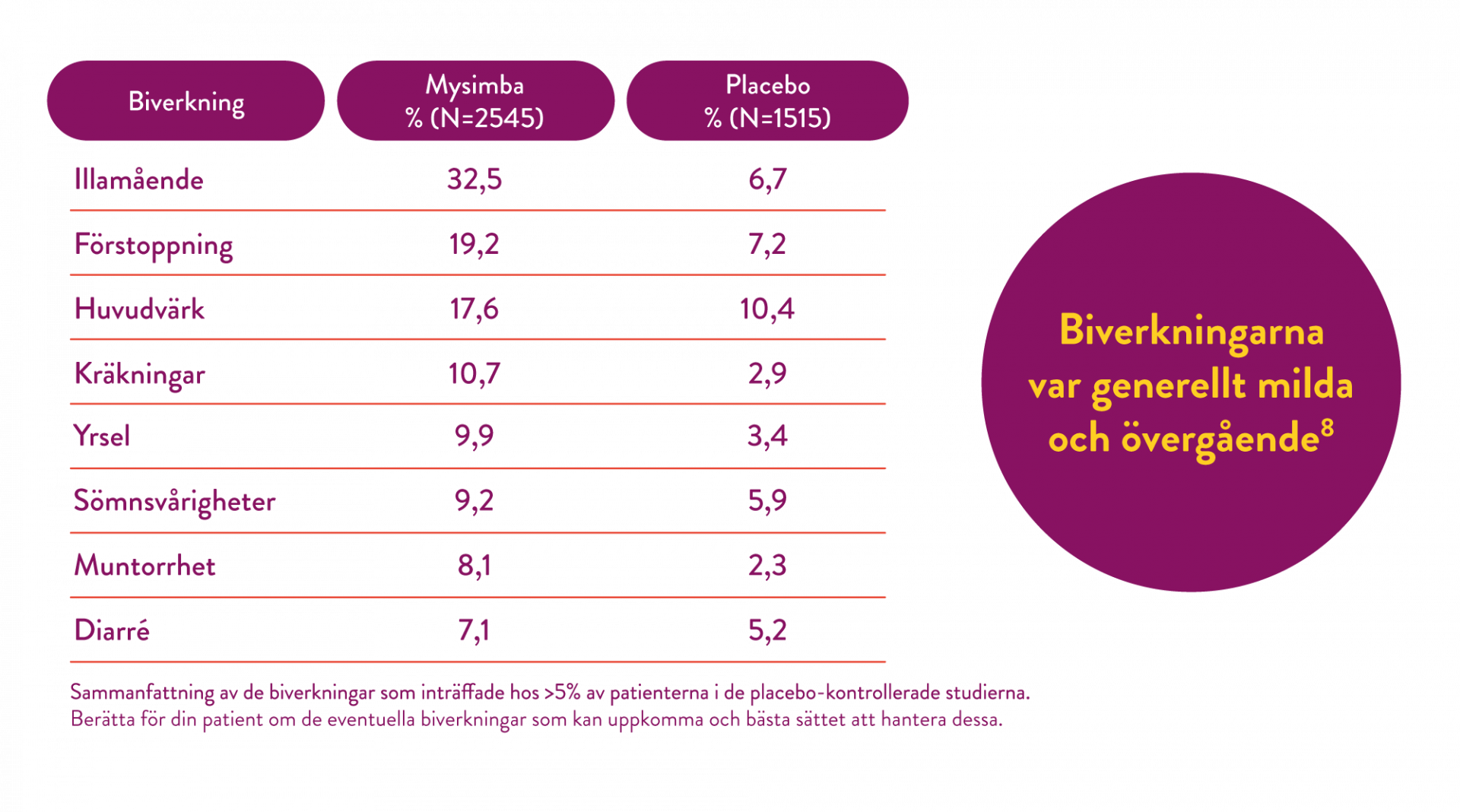
I samtliga kliniska studier uppnåddes en betydande viktminskning i kombination med kost- och motionsrådgivning från baseline som upprätthölls under följande 4 veckors uppföljningsintervaller fram till studierna avslutades. (5)
Utöver viktnedgång sågs statistiskt signifikanta förbättringar i triglycerider och HDL-kolesterol jämfört med placebo samtliga fyra fas 3-studier. (6-9)
51% av alla patienter reducerar sin initiala vikt med minst 5% efter 16 veckors behandling (5)
Det kliniska prövningsprogrammet visade att 51 % av patienterna kan förväntas få en viktminskning på minst 5% efter 16 veckors behandling. Dessa patienter kategoriseras som Mysimba-responders. (5)
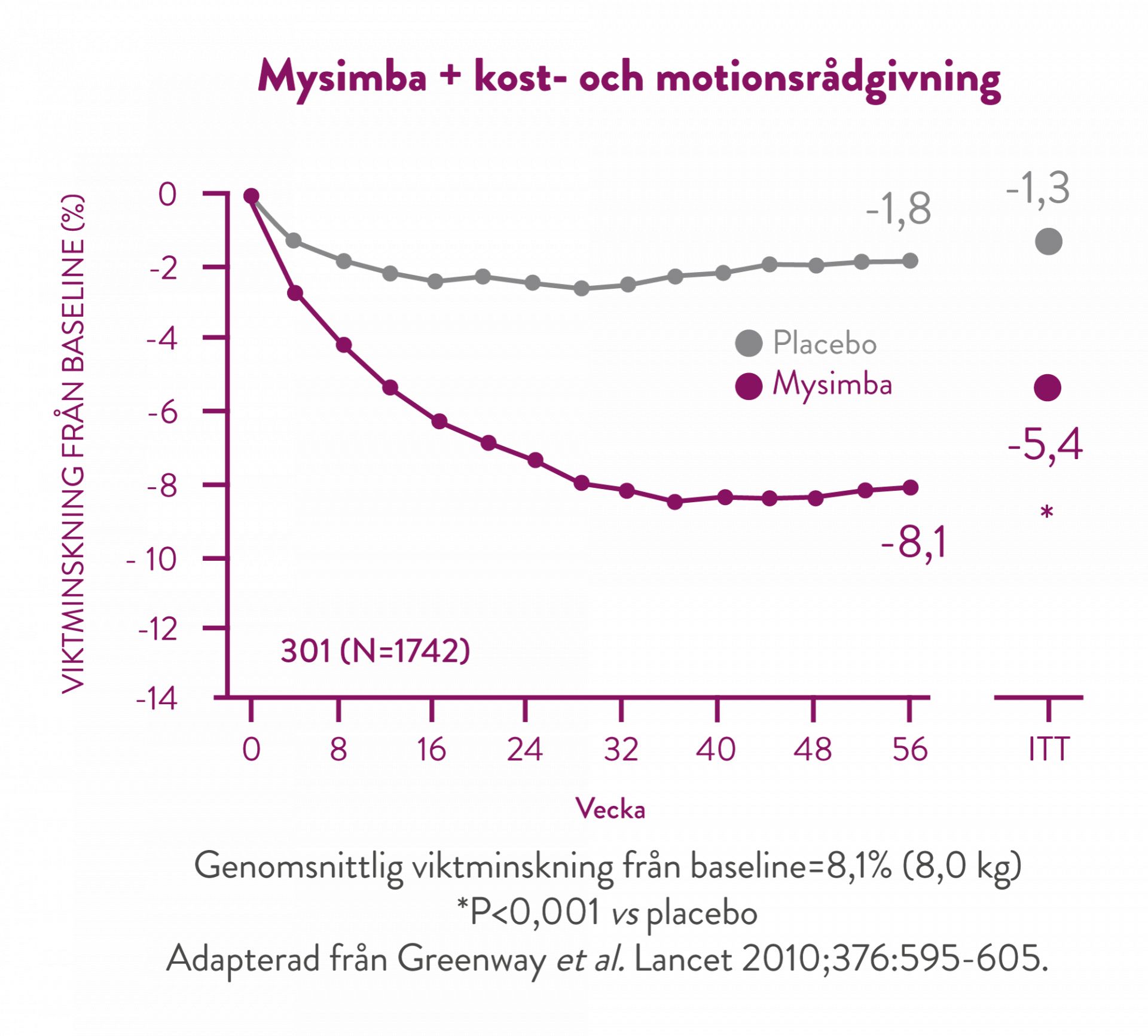
I denna studie fick samtliga deltagare individuell rådgivning om minskat kaloriintag och ökad fysisk aktivitet (30 minuter om dagen). (7)
Efter 56 veckors behandling har de patienter som uppnådde 5% viktminskning efter 16 veckor, uppnått en genomsnittlig viktminskning på 11,3%. (5)
Behandling med Mysimba ska avbrytas efter 16 veckor om patienten inte har tappat minst 5 % av sin initiala kroppsvikt. (1, 5)
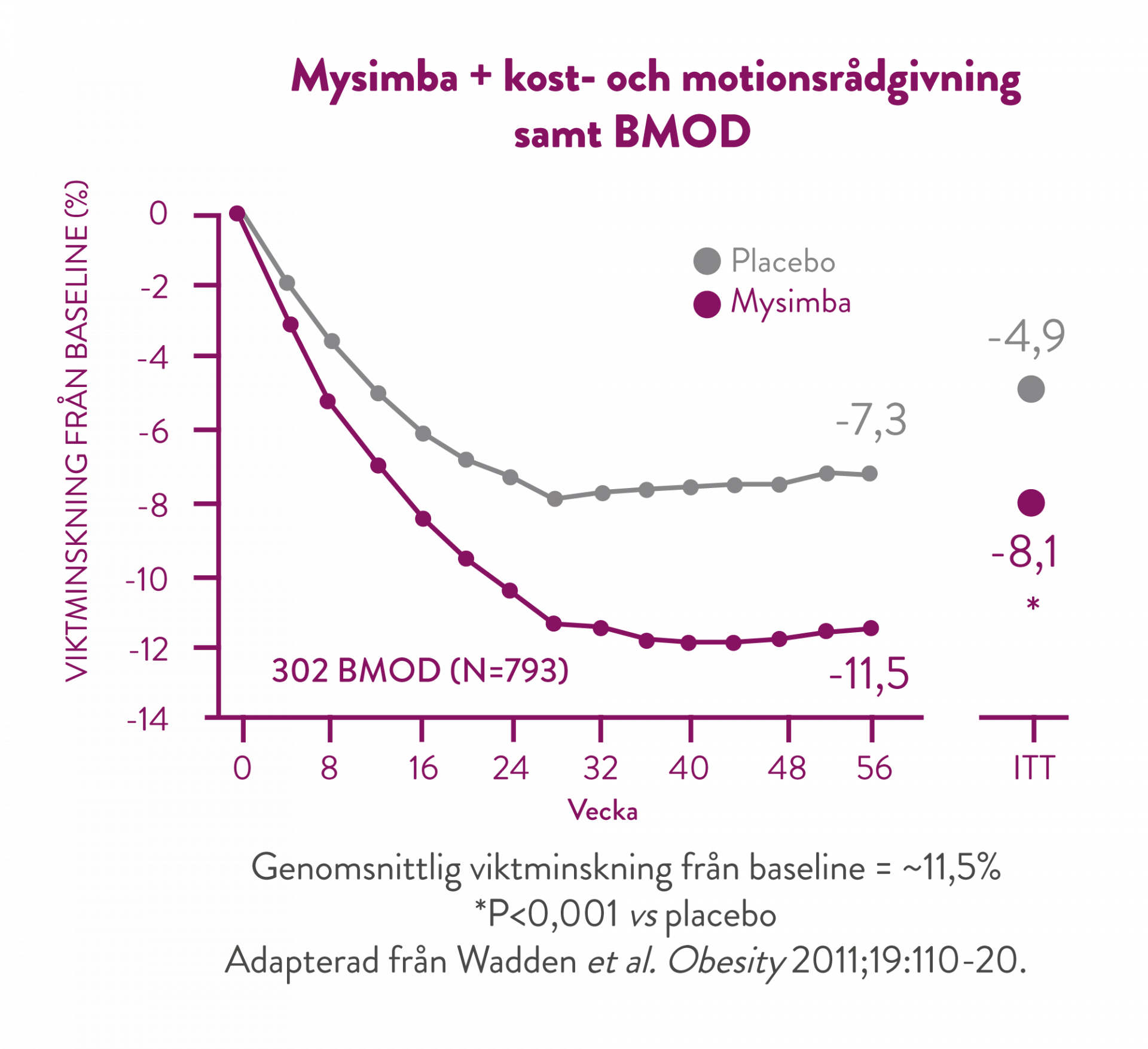
I denna studie fick deltagarna ta del av ett intensivt beteendeförändringsprogram (BMOD, behavior modification) bestående av 28 gruppterapisessioner över 56 veckor samt en strängt föreskriven kost- och motionsregim. (9)
Andelen patienter som uppnådde minst 5% viktreduktion efter 16 veckor var 51% = responders.
Mysimba-responders och non-responders (5)
En annan effekt av Mysimba var att HbA1c minskade signifikant hos de försökspersoner som hade typ 2-diabetes och som fick behandling med Mysimba, jämfört med de som fick placebo. (8)
Mysimba har ingen godkänd indikation för behandling av typ 2-diabetes.
Tolerabilitet och säkerhet
Säkerhetsprofilen för Mysimba är dokumenterad i flera dubbelblinda, placebokontrollerade studier. (1, 6-9)
För att säkerställa rätt urval av patienter för behandling med Mysimba, ska även en checklista för förskrivning fyllas i.
Dosering och administrering
Mysimba är en tablett som ska sväljas hel tillsammans med vatten och gärna intas i samband med måltid. Tabletten får inte delas, tuggas eller krossas. (1)
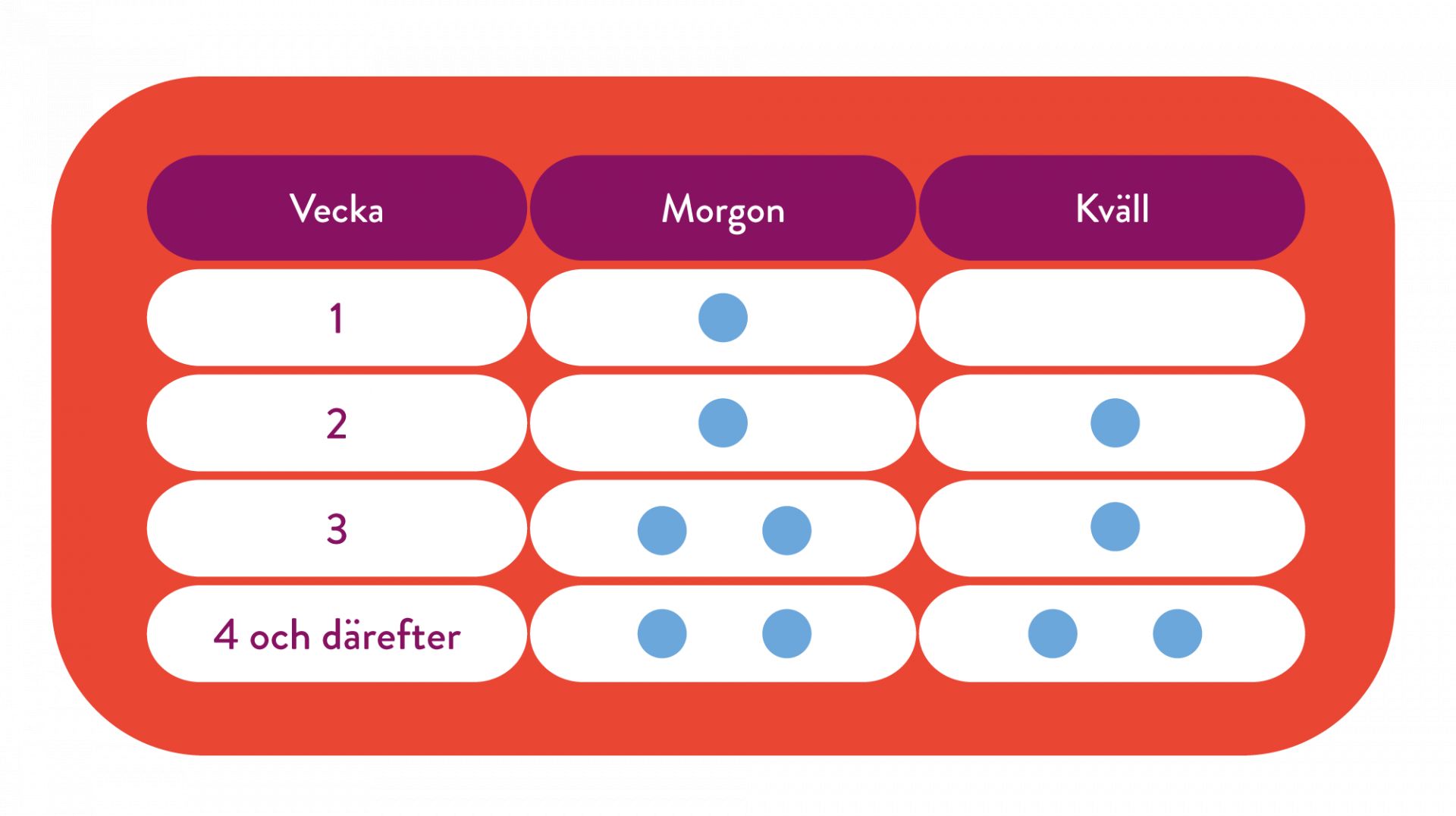
Mysimba ska dostitreras upp till maxdosen 2 tabletter 2 gånger dagligen. Dostitreringen sker under en 4-veckorsperiod enligt följande schema: (1)
Behovet för fortsatt behandling ska utvärderas efter 16 veckor och därefter varje år. Behandlingen ska avbrytas efter 16 veckor om patienten inte har tappat minst 5% av sin initiala kroppsvikt.
Om en dos missas ska patienten inte ta en ytterligare dos utan ta nästa förskrivna dos vid den vanliga tidpunkten. (1)
Varje tablett innehåller 8 mg naltrexonhydroklorid och 90 mg bupropionhydroklorid. Högsta rekommenderade dygnsdos av Mysimba är två tabletter två gånger dagligen till en total dos på 32 mg naltrexonhydroklorid och 360 mg bupropionhydroklorid. (1)
Uppföljning
Tidig och kontinuerlig uppföljning/kontakt med patienter under behandling av obesitas är viktig och rekommenderas enligt flera riktlinjer för övervikt och fetma. (10)
Referenser
- Mysimba Produktresumé januari 2025.
- Greenway FL. Physiological adaptions to weight loss and factors favouring weight regain. International Journal of Obesity 2015;39: 1188-96.
- Müller MJ, et al. Changes in energy expenditure with weight gain and weight loss in humans. Current Obesity Reports 2016;5:413-23.
- Sumithran P, et al. Long-term persistence of hormonal adaptions to weight loss. New England Journal of Medicine 2011;365:1597-1604.
- Fujioka K, et al. The relationship between early weight loss and weight loss at 1 year with naltrexone ER/bupropion ER combination therapy. Int J Obesity 2016;40:1369-75.
- Apovian CM, et al. A randomized, phase 3 trial of naltrexone SR/bupropion SR on weight and obesity related risk factors (COR-II). Obesity 2013;21:935-43.
- Greenway FL, et al. Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): a multicenter, randomized, double-blind, placebo-controlled, phase 3 trial. Lancet 2010;376:595-605.
- Hollander P, et al. Effects of naltrexone sustained-release/bupropion sustained-release combination therapy on body weight and glycemic parameters in overweight and obese patients with type 2 diabetes. Diabetes Care 2013;36:4022-9.
- Wadden TA, et al. Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: the OR-BMOD
- WHO. Preventing and managing the global epidemic. Report on a WHO consultation on obesity, Geneva, 3–5 June 1997
EU/1/14/988
Utdrag från Produktresumé
▼Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning.
Mysimba (naltrexon/bupropion) 8 mg/90 mg depottabletter, Antiobesitasmedel, centralt verkande. Rx, EF.
Indikation: Avsett som tillägg till en kalorireducerad kost och ökad fysisk aktivitet för vikthantering hos vuxna patienter (≥ 18 år) med ett initialt BMI på ≥ 30 kg/m2 (fetma) eller ≥ 27 kg/m2 till < 30 kg/m2 (övervikt) tillsammans med en eller flera viktrelaterade komorbiditeter (t.ex. typ 2-diabetes, dyslipidemi eller kontrollerad hypertoni). Behandling ska avbrytas efter 16 veckor om patienten inte har tappat minst 5 % av sin initiala kroppsvikt. Behovet för fortsatt behandling ska utvärderas efter 16 veckor och utvärderas på nytt varje år. Behandling med Mysimba ska avbrytas efter ett år om patienten inte bibehållit en minskning på minst 5 % av initial kroppsvikt.
Kontraindikationer: Överkänslighet mot något innehållsämne, okontrollerad hypertoni, aktuell epileptisk sjukdom eller tidigare krampanfall i anamnesen, känd tumör i CNS, akuta utsättningssymtom efter utsättande av alkohol eller bensodiazepiner, bipolär sjukdom i anamnesen, samtidig behandling med bupropion eller naltrexon, aktuell eller tidigare diagnos på bulimi eller anorexia nervosa, beroende av opioider eller behandling med opioidagonister, akuta opioidutsättningssymtom, samtidig behandling med MAO-hämmare, allvarligt nedsatt leverfunktion, terminal njursvikt.
Varningar och försiktighet: Säkerhet och tolerabilitet ska utvärderas med jämna mellanrum. Behovet för fortsatt behandling ska utvärderas efter 16 veckor och sedan varje år. Behandlingen ska avbrytas om det finns osäkerhet kring säkerhet eller tolerabilitet med pågående behandling, inklusive osäkerhet kring blodtrycksökning. Varning och försiktighet uppmanas för: patienter med självmordstankar eller självmordsbeteende, patienter med ökad risk för krampanfall, patienter som får opioider, försök att övervinna blockad av naltrexon genom administrering av stora mängder exogena opioider, allergiska reaktioner, svåra kutana biverkningar, blodtrycksstegring, aktiv kranskärlssjukdom eller cerebrovaskulär sjukdom i anamnesen, Brugada syndrom, levertoxicitet, äldre patienter över 65 år, nedsatt njur- och leverfunktion, serotoninsyndrom vid samtidig behandling med serotonerga medel, patienter med psykiska störningar i anamnesen. Innehåller laktos. Risk för interaktion med läkemedel som metaboliseras av CYP450-enzymer, CYP2D6-substrat, CYP2B6-inducerare, -hämmare och -substrat, och OCT2-substrat. Konsumtion av alkohol ska minimeras eller undvikas. Ges med försiktighet till patienter som behandlas med levodopa eller amantadin, hämmare eller inducerare av UGT 1A2 och 2B7, läkemedel som är kända för att hämma metabolism (ex valproat). Samtidig administrering med digoxin kan minska plasmanivåerna av digoxin.
Graviditet och amning: Ska inte användas under amning, graviditet eller av kvinnor som försöker att bli gravida.
Effekter på förmågan att framföra fordon och använda maskiner: Har effekt på förmågan att framföra fordon och använda maskiner. Yrsel, sömnighet, medvetslöshet och krampanfall kan förekomma under behandling.
För ytterligare information, se: www.fass.se
Datum för senaste översyn av produktresumé 05/2025. Navamedic AB, Göteborgsvägen 74, Sävedalen, +46 31 335 1190, www.navamedic.com.
Rev. 06/2025
Mysimba är ett varumärke registrerat av Nalpropion Pharmaceuticals LCC. © 2020
MYS-0179-004 06/24